Proceso y Desarrollo del PBL disoluciones
1. Lo primero de todo lo que tendremos que hacer será hallar cuanto volumen de disolución tenemos en el bote de plástico, para este paso utilizaremos una probeta grande con precisión de 2 ml. Podéis ver en las fotos nuestro resultado: 188 ml.



2. Ahora tendremos que descubrir la densidad de la disolución
Vamos a calcular la densidad de nuestro compuesto, pero,
¿qué es la densidad?
En física y Química, la densidad es una magnitud referida a la cantidad de masa en un determinado volumen de una sustancia o un cuerpo. Por tanto, la densidad es el resultado de dividir la masa por el volumen (D=M/V). Su unidad en el sistema internacional es el Kilogramo por metro cúbico.
En física y Química, la densidad es una magnitud referida a la cantidad de masa en un determinado volumen de una sustancia o un cuerpo. Por tanto, la densidad es el resultado de dividir la masa por el volumen (D=M/V). Su unidad en el sistema internacional es el Kilogramo por metro cúbico.
Como la cantidad de líquido que tenemos no es mucha,
utilizaremos en nuestro PBL el gramo por centímetro cúbico. Lo que tenemos que
hacer para calcular la densidad es lo siguiente:
- Coger 10 ml de la sustancia con una probeta
- Pesar los 10 ml con la báscula en un cristalizador
- Realizar las diferentes cuentas: paso de centímetro cúbicos a mililitros y cálculo de la densidad con la masa y el volumen (M=10.740 g/ V= 10 ml). El resultado de la densidad es de 1.074 g/cc
En las imágenes podéis observar todo el proceso realizado en
orden:
 |
| 10 ml de la disolución |
 |
| Masa de los 10 ml de disolución |
 |
| Cálculos para hallar la densidad |
El líquido que utilizamos lo dejaremos en el cristalizador
para que el próximo día averigüemos la concentración de la sustancia.
Hay que decir que realizamos este experimento 2 veces, la
primera descubrimos que tenía un 15 % de error, así que como buenos científicos
volvimos a realizar el experimento para asegurarnos más.
3. El siguiente paso para solucionar el PBL es hallar la concentración en G/L
¿Sabéis todos lo que es la concentración? Seguro que si,
pero por si acaso aquí tenéis una breve información:
Concentración: la concentración
de una disolución es la proporción o relación que hay entre la cantidad de
soluto y la cantidad de disolvente, donde el soluto es la sustancia que se
disuelve, el disolvente es la sustancia que disuelve al soluto, y la disolución
es el resultado de la mezcla homogénea de las dos anteriores.
Litros de disolución
Deducida esa fórmula, vamos a averiguar cual es el valor de cada uno de
los términos de la fórmula anterior:
- Gramos del soluto: Lo primero que hicimos fue coger 10mL de nuestra disolución con una probeta, y lo vertimos en una placa Petri de la cual sabíamos ya su peso. Tras una semana de reposo y evaporación, en la clase siguiente apareció solo la sal cristalizada ya que el agua se había evaporado anteriormente. Pesamos el conjunto completo y de este resultado restamos el peso de la placa que habíamos realizado anteriormente. Y ya está: ya tenemos el peso del soluto (NaCl)
- Litros de disolución: En este caso hemos utilizado los 10 mL empleados para averiguar los gramos de soluto
Este procedimiento lo llevamos a cabo dos veces, siendo la
segunda mucho mas exacta
·
Solución :
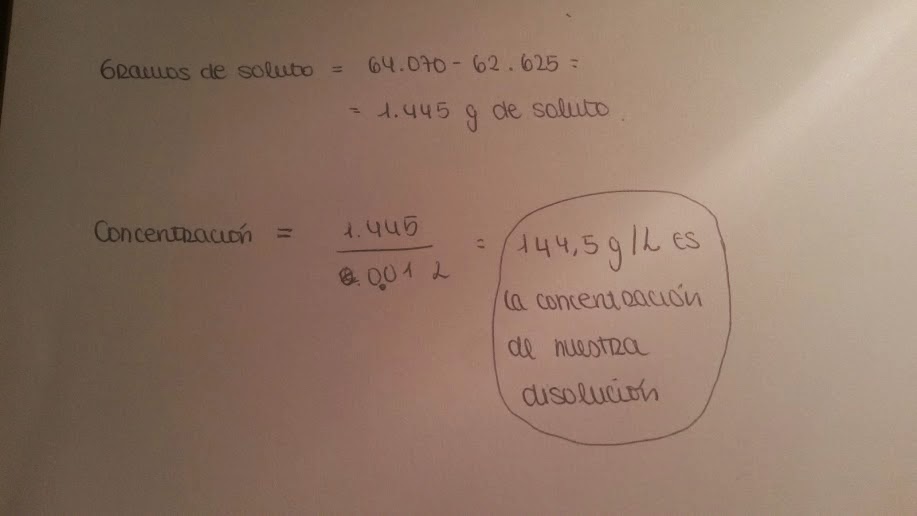 |
| Cálculo de la concentración en G/L |
Después de conseguir esta información, devolvimos la sal cristalizada a la placa Petri para no perder nada, diluyéndola en 10ml, para reponer los evaporados.


Nuestros químicos en pleno proceso de recuperación de los 10 ml y la sal
4. Ya casi acabando toca calcular la molaridad
Como siempre, una breve información sobre la molaridad, que
quizá sea el concepto que menos controlábamos
La molaridad, se define como la cantidad de sustancia de soluto,
expresada en moles, contenida en un cierto volumen de disolución, expresado en
litros, es decir:
M = n / V.
M= Núm. moles de soluto
(mol) / Volumen de disolución (L)
El primer término con el que trabajamos en la fórmula es el
número de moles. Eso, a su vez lo hallamos gracias a una fórmula:
Masa molar
Esto se resuelve de la siguiente manera
 |
| Cálculo de moles de soluto |
Por tanto, la molaridad quedaría de la siguiente manera:
 |
| Cálculo de la Molaridad |
Para calcular esta cifra no hemos tenido que realizar nada
mas, con nuestra disolución, nos ha servido con los datos que teníamos.
Para acabar debíamos entregar diferentes soluciones:
1º Calcular cuánto
cuesta la sal contenida en el frasco
Para ello llevamos a cabo un sencillo sistema de
proporciones, averiguando primero la cantidad de sal total contenida en el frasco, y así, averiguar después su
valor
 |
| Cantidad de sal total |
 |
| Precio total de la sal del frasco |
2º Calcular la cantidad de disolución necesaria para que el
vendedor se lleve 12g de sal
Como recordaréis el vendedor exigía llevarse un bote con 12 gramos de sal de la disolución original, con el frasco etiquetado con su densidad, concentración y cantidad de líquido. Otra vez propusimos otro sistema de proporciones que nos
llevó a la solución: 83.05 mililitros tenía que tener el frasco.
Tras esto colocamos en el frasco esta cantidad exacta, y el
resto lo echamos en un matraz común de la clase. En la foto podéis ver el frasco ya etiquetado y con la cantidad de líquido.
3º Tenemos que calcular la cantidad de dinero que hay que pagar al comerciante por la cantidad de sal disuelta en 50 ml
Como ya sabéis, el vendedor nos pedía que le comprásemos la cantidad de sal disuelta en 50 ml de esta disolución. Para averiguarlo solo tendremos que realizar una simple regla de tres:
Con otra regla de tres hemos averiguado (se ve en los cálculos) que tenemos que pagarle 7225 €
Con otra regla de tres hemos averiguado (se ve en los cálculos) que tenemos que pagarle 7225 €
3º Por último calculamos el beneficio que nos reportará todo esto:
¿Para qué íbamos a hacer todo esto solo para ganarnos una nota de ampliación? ¡Lo hemos hecho por el beneficio que nos reporta! En la foto podéis ver los cálculos necesarios para hallar el beneficio:
Como ya habréis comprobado tendremos un beneficio total de 7941 €, una cantidad considerable de dinero a repartir entre los tres a partes iguales (2647 €)
 Pues nada amigos físicos, esto es todo el PBL, esperamos que les haya gustado y lo hayan comprendido todo, si tienen cualquier duda no duden en escribirla en un comentario. Gracias por leernos, no duden en comprar sal ahora para que no se ponga más cara y hasta la próxima :)
Pues nada amigos físicos, esto es todo el PBL, esperamos que les haya gustado y lo hayan comprendido todo, si tienen cualquier duda no duden en escribirla en un comentario. Gracias por leernos, no duden en comprar sal ahora para que no se ponga más cara y hasta la próxima :)






















